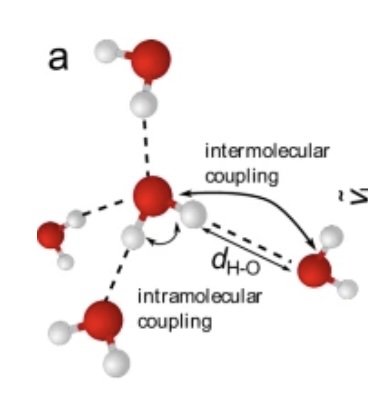
Watermoleculen binden via waterstofbruggen asymmetrisch aan hun buren (afb: Johannes Hunger et al./Nature Communications)
Water is een vreemd goedje. Je zou denken dat zo’n simpel molecuul van twee waterstofatomen en een zuurstofmolecuul zich heel voorspelbaar gedraagt, maar dat is allesbehalve waar. Zo drijft ijs (vast water) op vloeibaar water, terwijl vaste stoffen in de regel zwaarder zijn dan vloeibare) en heeft water met een temperatuur van 4°C de grootste soortelijke massa. Nu blijkt dat simpele, zeer symmetrisch ogende watermolecuul ook nog niet eens symmetrisch te zijn. Het watermolecuul bindt met de ene kant sterker dan met de andere met omliggende watermoleculen. Zo kunnen, kortstondig, ring- of ketenstructuren ontstaan. Ligt daar het geheim van waters vreemdheid?
Gelukkig maar dat ijs lichter is dan water, anders hadden we nooit kunnen schaatsen (maar hadden we dat fenomeen ook niet gekend). Al eeuwen wordt er gezocht naar de oorzaak van dat vreemde gedrag en wellicht dat we (wij mensen) wat dichter bij de kern komen met die jongste ontdekking van het Max Planckinstituut voor polymeeronderzoek.
Veel van die bijzondere eigenschappen van water berusten op de wisselwerking onderling tussen watermoleculen die verlopen via de waterstofatomen en aangeduid worden met waterstofbruggen. Een watermolecuul kan twee van die bruggen vormen.
Die bruggen blijven maar zeer korte tijd intact (in de orde van eenbiljoenste seconde) waarna weer nieuwe bruggen worden gesmeed enz. Daardoor zitten watermoleculen dichter op elkaar (dan zonder die bruggen), maar kunnen die zich toch ook goed bewegen. De sterkte van die bruggen zou, verwacht je dan, louter toevallig moeten zijn.
Je had het al voelen aankomen (en het was al verklapt): dat is niet zo. De onderzoekers onder aanvoering van Johannes Hunger heeft vastgesteld dat de bruggen van de twee waterstofatomen van een watermolecuul niet even sterk zijn (dus asymmetrisch). De ene is sterker dan de ander, waardoor de afstand tot de buren ook verschillend is.
Structuur
Daardoor ontstaat er in de eigen ordeloze vloeistof een structuur, waardoor er verschillende vormen avn aan elkaar gekoppelde moleculen kunnen ontstaan zoals ringen of langgerekte ketens. Die structuren zorgen ervoor dat (vloeibaar) water niet gezien moet worden als een ordeloze bende, maar een min of meer gestructureerd materiaal dat andere regels volgt dan ‘ordeloze’ vloeistoffen.
Om deze asymmetrie te kunnen ontdekken mengden de onderzoekers water met een andere vloeistof, zodat ze beter afzonderlijke watermoleculen konden bekijken. Met behulp van lasers lieten ze de watermoleculen trillen en onderzochten hoe die trillingen elkaar wederzijds beïnvloedden. Op die manier zouden ze achter de asymmetrisch binding zijn gekomen.
Bron: idw-online.de
