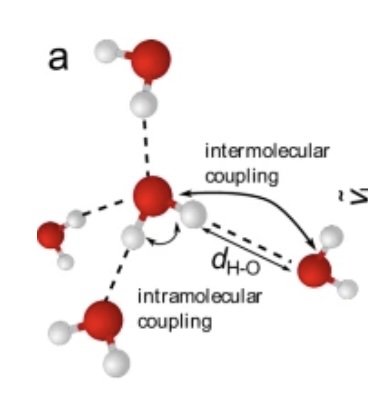
Watermoleculen binden via waterstofbruggen asymmetrisch aan hun buren (afb: Johannes Hunger et al./Nature Communications)
Water is een vreemd goedje. Je zou denken dat zo’n simpel molecuul van twee waterstofatomen en een zuurstofmolecuul zich heel voorspelbaar gedraagt, maar dat is allesbehalve waar. Zo drijft ijs (vast water) op vloeibaar water, terwijl vaste stoffen in de regel zwaarder zijn dan vloeibare) en heeft water met een temperatuur van 4°C de grootste soortelijke massa. Nu blijkt dat simpele, zeer symmetrisch ogende watermolecuul ook nog niet eens symmetrisch te zijn. Het watermolecuul bindt met de ene kant sterker dan met de andere met omliggende watermoleculen. Zo kunnen, kortstondig, ring- of ketenstructuren ontstaan. Ligt daar het geheim van waters vreemdheid?
Lees verder
